ゲノムの時代へ
膨大な情報を、
わたしたちは自在にあやつって、
新しい時代を拓くことができるのか、
やがてくる明日への羅針盤に
ゲノムの変異の実験的効果予測 ~BRCA1タンパク質の機能測定からみえるもの~
図を拡大
 ヒトゲノム全体が解読されてから、現在ではゲノムの多様性を解明する研究が盛んに進められています。メンデル遺伝性疾患の場合、原因遺伝子に観察されるそれぞれのバリアントが、疾患の原因となるのかどうかを判断することはとても重要です。これまでの研究で報告されている病的バリアント(疾患の原因となるバリアント)の情報はデータベースに蓄積されてきているので、着目するバリアントが病的バリアントであるか、あるいはその可能性が高いと報告されているものかどうかを確認することは、専門家により広く行われています。しかしヒト集団中には、本当は疾患原因のバリアントであっても、まだ論文などで報告されていないものも存在しますし、人が世代交代を続けている以上、突然変異により新たなバリアントが発生します。では、どうすればより良い判断ができるでしょうか?
ヒトゲノム全体が解読されてから、現在ではゲノムの多様性を解明する研究が盛んに進められています。メンデル遺伝性疾患の場合、原因遺伝子に観察されるそれぞれのバリアントが、疾患の原因となるのかどうかを判断することはとても重要です。これまでの研究で報告されている病的バリアント(疾患の原因となるバリアント)の情報はデータベースに蓄積されてきているので、着目するバリアントが病的バリアントであるか、あるいはその可能性が高いと報告されているものかどうかを確認することは、専門家により広く行われています。しかしヒト集団中には、本当は疾患原因のバリアントであっても、まだ論文などで報告されていないものも存在しますし、人が世代交代を続けている以上、突然変異により新たなバリアントが発生します。では、どうすればより良い判断ができるでしょうか?
この課題へのアプローチの仕方は一つではないのですが、最近、ゲノム編集技術を活用した画期的な論文が発表されました※。遺伝性乳癌卵巣癌症候群の原因遺伝子の一つとしてBRCA1が知られていますが、この研究では、BRCA1タンパク質の機能的に重要な部分の塩基配列について、あり得る全ての一塩基変異のゲノム編集実験を行いました。そして、BRCA1タンパク質が本来の機能を発揮しているかどうかを、細胞の生き残りの程度で計測しました。実際に、約4,000の一塩基変異の機能への効果を測定し、その分布は二峰性を示すことが分かりました。機能測定の結果の分析により、それぞれの変異が病因性をもつかどうかという予測について、有効な手法であることが分かりました。
この研究の手法は、他の重要な機能をもつ遺伝子についても適用できることはもちろん、得られたデータから見えてくることは、遺伝医学的側面のみならず、タンパク質の機能を保ちながら変異できる範囲など、基礎研究においてもインパクトが大きいと考えられます。また、実験的な変異の効果予測は、近い将来の詳細な研究の蓄積を先回りしているところがあり、バリアントの解釈方法の進展が加速していくことを示しています。これまでは、効果の不明なバリアントが沢山残っていたところ、本研究のような手法により得られた知見を活用することで、病的バリアントがどれであるかの判断がしやすくなるので、ゲノムに基づく個別化医療・予防の精度が高まることが期待されます。
※ 参考文献
Accurate classification of BRCA1 variants with saturation genome editing | Findlay GM, et al. | Nature 562(7726):217-222, 2018. | doi: 10.1038/s41586-018-0461-z
私にピッタリの薬とは? -薬効や副作用の個人差-
図を拡大
 はるか昔から病気の治療に薬は欠かせません。近年ではドラッグストアを始め、コンビニやインターネットなどでも気軽に多くの種類の市販薬を購入することができるようになり、薬選びに関心を持つ人も多いはずです。
はるか昔から病気の治療に薬は欠かせません。近年ではドラッグストアを始め、コンビニやインターネットなどでも気軽に多くの種類の市販薬を購入することができるようになり、薬選びに関心を持つ人も多いはずです。
現在の薬物治療では、多くの人に効果があるように、なおかつ多くの人で副作用が最小限になるように、患者さんの疾患や症状によって薬の種類や投与量の目安が定められています。しかし、同じ風邪薬を同じ量服用したとしても、効果が出やすいヒトもいれば、眠気が出やすいヒトもいるように、薬の効果や副作用には個人差が生じる場合があります。この違いは何に由来するのでしょうか?
最近の研究で、薬を代謝する酵素や吸収・排泄に関わるトランスポーターの遺伝子のDNA配列の違いで薬の効果や副作用の発現に個人差が生じることが明らかになってきています。例えば、ヒトの主要な薬物代謝酵素であるシトクロムP450(CYP)の一種、CYP2C19は日本人の5人に1人の割合で活性が低いと言われており、活性が低いヒトは胃潰瘍や十二指腸潰瘍の原因となるピロリ菌の除菌において、より低用量で除菌が奏効する可能性が高くなります。
抗がん剤の代謝に関わる酵素にも個人差があります。主に胃がん、大腸がん、乳がんなどの固形がんの治療に用いられるフッ化ピリミジン系抗がん剤は、投与患者の約10~30%に重篤な副作用が出ると言われています。この抗がん剤は、5-Fluorouracil (5-FU) を活性本体とし、体内でジヒドロピリミジンデヒドロゲナーゼ(DPD)とジヒドロピリミジナーゼ(DHP)という酵素により代謝されるため、酵素の活性が低下する遺伝子多型を持っているヒトは下痢や嘔吐、骨髄抑制などの副作用が出やすくなるのです。抗がん剤治療において、重篤な副作用の発現は治療の中断や患者さんの死亡につながる可能性のある大きな問題です。東北メディカル・メガバンク機構が実施した日本人集団の全ゲノム解析を利用した研究で、DPD酵素活性の低下する可能性のあるヒトはなんと16人に1人の割合で存在していることも明らかになりました。
このように薬の効果や副作用の個人差は、遺伝子多型によって薬を代謝する酵素の活性に違いが生じることが原因のひとつであるとされます。そのため、薬の投与前に遺伝子検査を行うことで、患者さんひとりひとりに合った薬や量を選択することが可能になり、副作用を最低限にかつ薬の効果を最大限に発揮できる薬物治療を行う未来型医療の実現が期待されます。
【関連リンク】
抗HIV薬の効果や副作用発現に関与する薬物代謝酵素の遺伝的特性を解明 -CYP2B6遺伝子多型に基づく個別化薬物療法の展開を視野に-
抗がん剤の重篤な副作用発現に影響を及ぼす薬物代謝酵素の遺伝的特性を解明- 5-フルオロウラシル系抗がん剤の個別化薬物療法実現へ期待 -【プレスリリース】
遺伝子から分かる! 緑内障の原因 -個別化医療への道-
図を拡大
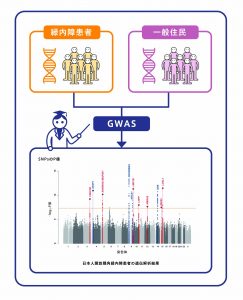 緑内障は視神経が障害を受ける眼の疾患で、近年日本人の失明原因の第一位となっています。日本人における緑内障の有病率は5.0%にものぼり、一般的な病気であると言えます。その主な病気のタイプである開放隅角緑内障の遺伝要因の大部分は、今まで解明されていませんでした。
緑内障は視神経が障害を受ける眼の疾患で、近年日本人の失明原因の第一位となっています。日本人における緑内障の有病率は5.0%にものぼり、一般的な病気であると言えます。その主な病気のタイプである開放隅角緑内障の遺伝要因の大部分は、今まで解明されていませんでした。
今世紀に入り、ヒトゲノムプロジェクトの成果としてヒトゲノム配列が明らかにされ、一塩基多型(SNP)などのデータベースは急速に充実してきています。そのSNPを用いたゲノムワイド相関解析(Genome-wide association study:GWAS)によって、疾患に関連する遺伝子多型を検出することが可能となってきました。我々は、まだまだ高価な全ゲノム解析ではなく、安価で日本人集団のもつSNPを全ゲノム領域にわたり高精度で取得できる、SNPアレイ「ジャポニカアレイ®」を用いて緑内障遺伝子解析を行いました。緑内障の遺伝要因を探るため、565人の患者さんの遺伝情報を解析し、欧米において緑内障との関連が報告されている3つの遺伝子領域が日本人緑内障患者にも関与していること、この3つの遺伝子領域は、眼圧、視神経の血流や形状など異なる臨床的特徴と関連することを明らかにしました。
また、東北メディカル・メガバンク機構で解析した正常対照の遺伝子頻度も用いてアジア最大のGWASを実施し、緑内障の発症に関わる新たな7カ所の感受性遺伝子領域を同定しました。今まで、緑内障は生活習慣病と関係すると言われていましたが、遺伝子解析の点からはなかなか裏付けはありませんでした。今回、開放隅角緑内障が、2型糖尿病や心血管病と遺伝的背景を共有していることを明らかにしており、今後の緑内障の予防への有用な情報になると思われます。
これからの緑内障診療は、このような遺伝子解析を駆使し、
(1) 緑内障の罹患予測、リスク(かかりやすさ)判定
(2) 進行の予測
(3) 薬剤の選択、薬物に対する反応(効きやすさ)の予測
の個別化予防、個別化医療に向かうと考えられます。
【関連リンク】
開放隅角緑内障に関わる新たな7遺伝子領域を同定-1万5,000人の緑内障患者のゲノム解析から病因の解明へ-
緑内障の個別化医療への第一歩 – 緑内障の遺伝要因と臨床的特徴の関連を同定 -【プレスリリース】
水槽に隠された複数の謎を解き明かす ~ゲノムワイド関連解析(GWAS)による原因遺伝子探索~
宇宙で暮らすために大事な遺伝子?
図を拡大
 人類にとって宇宙は多くの可能性を秘めた空間です。これまでに多くの宇宙飛行士が宇宙へ行き、現在では地上約400 kmに建設された国際宇宙ステーション(ISS)での宇宙飛行士の長期滞在が行われています。たくさんの人が行ってみたいと憧れる場所ですが、誰もが行けるわけではなく、暮らすことなど遠い未来の話…。
人類にとって宇宙は多くの可能性を秘めた空間です。これまでに多くの宇宙飛行士が宇宙へ行き、現在では地上約400 kmに建設された国際宇宙ステーション(ISS)での宇宙飛行士の長期滞在が行われています。たくさんの人が行ってみたいと憧れる場所ですが、誰もが行けるわけではなく、暮らすことなど遠い未来の話…。
ところが、宇宙空間では、微小重力や宇宙放射線の影響により、体に様々な変化が引き起こされることがすでに分かってきています。無重力状態などの地上とは異なる環境は、人の体にストレスを生じさせ、短期間でも加齢と同じような変化が生じてきます。将来人類が宇宙で暮らすという大きな夢の実現には、解決しなければならない問題が多いのです。
宇宙航空研究開発機構(JAXA)は、ISSの日本実験棟「きぼう」に小動物飼育装置を設置し、宇宙でのマウス利用研究を開始しました。第3回マウス長期飼育ミッションとして、東北メディカル・メガバンク機構の山本雅之機構長が研究代表者をつとめる「宇宙ストレスにおける環境応答型転写因子Nrf2の役割」が行われています。これは、ストレス防御に重要なNrf2を欠失したマウス(Nrf2遺伝子ノックアウトマウス)をISSで飼育するミッションです。宇宙での滞在により生物に引き起こされる変化が加速すると予想されるので、酸化ストレスや毒物代謝に重要な遺伝子の発現を調節する転写因子であるNrf2の研究にこのミッションは非常に有効な手段なのです。
既に、2018年4月から1ヶ月間ほど、ISS内でNrf2遺伝子ノックアウトマウスが飼育され、2018年5月6日に無事全てのマウスが地球に帰還しました。私は、研究チームの一員として研究に参加しています。現在、詳しい解析を進めているところですが、宇宙空間で飼育したNrf2遺伝子ノックアウトマウスを解析することで、宇宙環境における遺伝子発現調節の一端が明らかにできると期待しています。人類が宇宙で暮らすための歩みは一歩一歩進んでいます。
【関連リンク】
国際宇宙ステーション 日本実験棟「きぼう」における小動物飼育ミッションについて
世界初、遺伝子ノックアウトマウス(特定遺伝子を欠失したマウス)の全数生存帰還に成功~国際宇宙ステーション日本実験棟「きぼう」より~
動く遺伝因子とトウモロコシ ~深ーい研究の歴史と現在~
図を拡大
 みなさん、トウモロコシは好きですか?日本で食用として売られているトウモロコシの実の色は、たいてい黄色一色か、あるいは時々白い粒が混じっている程度ですが、一粒一粒それぞれが、めしべ(絹糸)に受粉してできた子どもたちなのです!トウモロコシ(イネ科の植物)は種類によっては、紫色が出るものもあったりして、一粒一粒それぞれが個性を持っています。遺伝と聞くと、親から継承されるもので、組み換えや稀な突然変異以外では変わらないもの、というイメージがあるかもしれません。
みなさん、トウモロコシは好きですか?日本で食用として売られているトウモロコシの実の色は、たいてい黄色一色か、あるいは時々白い粒が混じっている程度ですが、一粒一粒それぞれが、めしべ(絹糸)に受粉してできた子どもたちなのです!トウモロコシ(イネ科の植物)は種類によっては、紫色が出るものもあったりして、一粒一粒それぞれが個性を持っています。遺伝と聞くと、親から継承されるもので、組み換えや稀な突然変異以外では変わらないもの、というイメージがあるかもしれません。
ところがじつは、ゲノムの中には「動く遺伝因子」があり、トランスポゾンと総称されています。トランスポゾンは特定のDNA断片を切り出し、別の場所に再挿入することで移動します。植物の形態や花の色の変化には、トランスポゾンの転移によるものがあります。トウモロコシの一粒の中にも、トランスポゾンが転移することで、色素産生に携わる遺伝子の発現が変化し、その結果、色の違う細胞群が生じることによって見た目には色のまだらとして観察されます。 この動く遺伝因子の発見とそれが世に認められるまで、バーバラ・マクリントックという1人の女性研究者抜きには語れません。(詳細は下記)
ヒトのゲノムにも、動く遺伝因子がありまして、レトロトランスポゾンと呼ばれる種類です。遺伝子領域にレトロトランスポゾンが挿入されることによって、遺伝子が本来の機能を発揮できず、疾患の原因になることもあります。これまでに、血友病、先天性の疾患各種、がんなど、レトロトランスポゾンの挿入が疾患の原因と考えられる例が120以上報告されています。
バーバラ・マクリントック(1902-1992)
バーバラ・マクリントックは、アメリカで活躍した細胞遺伝学者で、トウモロコシを主な実験対象としていました。1920-30年代の遺伝学の研究では、複数の形質と染色体を観察することによって、形質に関わる遺伝因子が染色体上にどのように並んでいるかの地図作りのようなことが進んでいまして、バーバラ・マクリントックは植物遺伝学において大きな貢献をしました。その後、1940年代から数年かけた注意深い研究により、動く遺伝因子があることを発表しました(1950-51年)。それはなんと、DNAの二重らせん構造の発表(1953年)よりも少し前のことだったのです! そしてずいぶん年月が経った1983年に、バーバラ・マクリントックは、ノーベル医学生理賞を受賞しました。
農業的に重要な栽培植物であるトウモロコシの全ゲノムは、2009年に解読が発表され、ゲノム中のトランスポゾンの全貌も明らかになりました。現在では、全ゲノム解読データや生命現象の網羅的なデータが得られるようになりました。しかしこのような現代の状況で、研究の歴史をたどってみると、バーバラ・マクリントックという先駆者が、注意深い観察と深い洞察により、ゲノムのダイナミックな側面に気づいた、ということは、数々の発見や発展の中の大事な一つとして、とても印象深いことです。
参考文献:
Science (2009) 326:5956 1112-1115 DOI: 10.1126/science.1178534
Mobile DNA (2016) 7:9. doi:10.1186/s13100-016-0065-9.
最新記事一覧
-
- きこえと遺伝子医療の現在
- 2025.12.26|宇佐美真一
-
- 人体を取りまく常在菌〜機能を知って共存しよう〜
- 2020.12.16|後藤まき
-
- なぜウイルスははやく変化するのか?
- 2020.09.08|山口由美
-
- 棒状で増やすか環状で増やすか―新たなシークエンサー開発―
- 2020.07.16|川嶋順子
-
- 新型コロナウイルスに対する抗体
- 2020.05.18|峯岸直子
