ゲノムの時代へ
膨大な情報を、
わたしたちは自在にあやつって、
新しい時代を拓くことができるのか、
やがてくる明日への羅針盤に
長く、直に読む技術へ シークエンサーの進歩
図を拡大
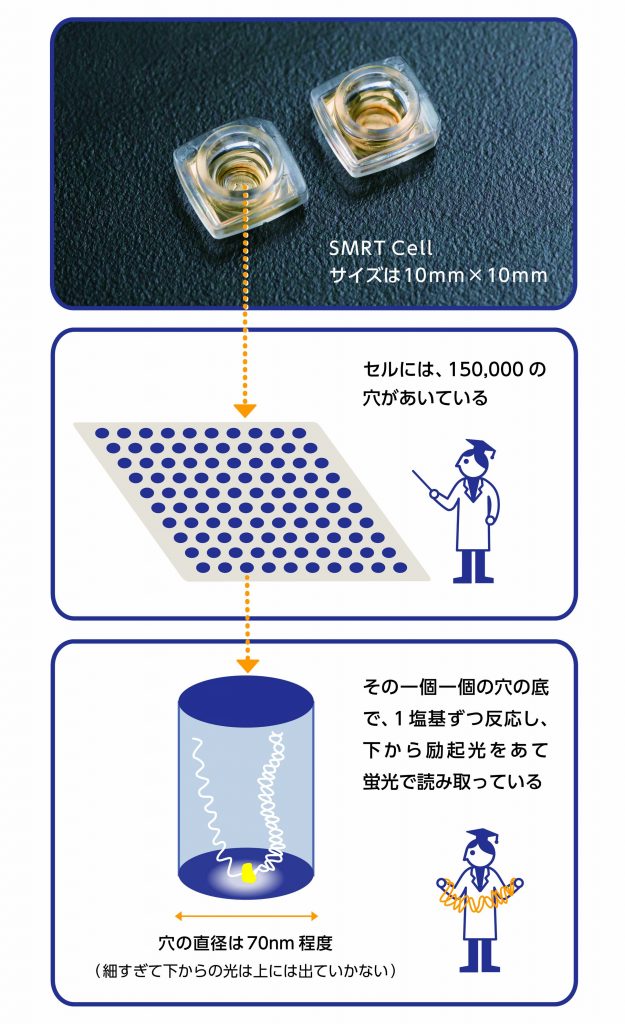 DNAの配列を解読する技術は、ここ十数年の間に驚異的な進歩を遂げました。昔は、サンガーシークエンス※1という方法で、DNAの断片を1本1本調べていましたが、次世代シークエンサーの登場により、数億から数十億本のDNA断片を一度に調べることが可能となりました。これにより、一昔前はヒト一人分のDNA配列を調べるのに10年以上かかりましたが、今はおよそ2日間で終わります。
DNAの配列を解読する技術は、ここ十数年の間に驚異的な進歩を遂げました。昔は、サンガーシークエンス※1という方法で、DNAの断片を1本1本調べていましたが、次世代シークエンサーの登場により、数億から数十億本のDNA断片を一度に調べることが可能となりました。これにより、一昔前はヒト一人分のDNA配列を調べるのに10年以上かかりましたが、今はおよそ2日間で終わります。
現在、主流の次世代シークエンサーは、蛍光色素を用いてDNA配列を解読しています。しかし、蛍光色素の検出感度が低いため、解析するDNA断片を増幅※2しなくてはならず、増幅しにくい部分の解析ができません。また、連続して200文字 (塩基) 程度しか読みとることができないため※3、ヒトゲノムで同じような配列が繰り返された場所などは、解読が困難です。
そんな中、全く異なる原理の「一分子長鎖シークエンサー」が注目されています。このシークエンサーも、蛍光色素を用いてDNA配列を解読しますが、検出感度が高いため、1分子 (1本) のDNAをそのまま、増幅することなく解析できます。また、連続して1万塩基以上読みとることができます。ただし、この一分子長鎖シークエンサー、まだ解析コストと解析にかかる時間の点で、多くの方のゲノムDNAを解読するのには適していません。しかし、ヒトゲノムの複雑な領域の解析に大きな威力を発揮するため、今後のさらに活用されていくものと思われます。最近では、蛍光色素を使わないで、直にDNA配列を解読する一分子長鎖シークエンサーも登場しました。蛍光の検出器がいらないため、シークエンサーを驚くほど小型化できるようです※4。今後も、「より長く、正確に、短時間で」DNA配列の解読技術は、更なる発展を遂げていくことでしょう。
【参考】
※1 サンガーシークエンス: フレデリック・サンガー博士が発明したDNA塩基の決定方法で、ジデオキシ法とも呼ばれる。サンガー博士はこの発明で1980年にノーベル化学賞を受賞しています。
※2 増幅: ポリメラーゼ連鎖反応 (PCR)と呼ぶ方法で行います。1本のDNAからその複製を作り、さらにその複製を作り、この反応を繰り返し、1000本程度に増やします。
※3 1000本に増やしたDNAが二人三脚ならぬ、千人千一脚をしていると想像してください。走り始めは、みんな息も揃っていますが、そのうち、早く走る人、遅く走る人とバラバラになって、しまいには走れなくなりますよね。それと同じイメージです。丁度200歩ぐらいで、反応がバラバラになってしまうのです。
※4 最近試験的に売りだされた次世代シークエンサーは、USBのメモリスティック程度の大きさで、実際にパソコンのUSBに挿して使用するものもあります。
【関連リンク】
日本人の基準ゲノム配列(JRG)を公開
遺伝子の発現のスイッチをONにする転写因子
図を拡大
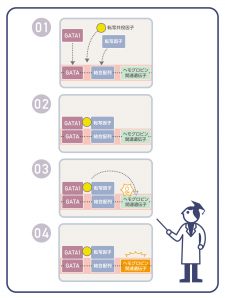 ヒトゲノムは、1セットあたり4種類の文字(A, T, G, C)を使って書かれた、約30億文字の言わば暗号配列です。しかし、タンパク質の設計図が書かれている部分は、暗号全体の数%です。それでは、残りの配列は何をしているのでしょうか。残りの配列の一部には、タンパク質が、どの細胞でいつ・どのくらい発現するか、厳密にコントロールするための配列(制御配列)が含まれています。私達の細胞は、基本的にどの細胞でも、つまり血液の細胞でも、皮膚になる細胞でも、同じゲノムを持っています。しかし、血液の基となる細胞が、血液の細胞になれたのは、血液で必要なタンパク質だけが、必要な時期に必要な量、発現したからです。例えば、血液で重要な遺伝子の近くにはG-A-T-Aという制御配列があり、血液で働くGATA-1と呼ばれる転写因子が認識して結合します。酸素を運搬するヘモグロビンをつくるのに必要な遺伝子の近くにも、-G-A-T-A-という配列があり、GATA-1転写因子が結合して遺伝子の発現をONにしています。しかし、G-A-T-Aという配列があれば、必ずそこにGATA-1が結合して、近くの遺伝子のスイッチをONにするのかというと、そうではありません。-G-A-T-A-の配列の周辺の配列や、協力して働く別の転写因子の結合する配列があるかなどの様々な条件が整って、初めてGATA-1が機能を発揮できるようになっています。さらに最近では複数の転写因子が結合したときに、その間をつなぐような働きをする転写共役因子の重要性も指摘されるようになってきました。制御配列も含めて、私たちのゲノムの多くの部分の機能は、分かっていません。ヒトの遺伝子の解読技術が飛躍的に進んだ現在、この制御配列の解明が期待されています。
ヒトゲノムは、1セットあたり4種類の文字(A, T, G, C)を使って書かれた、約30億文字の言わば暗号配列です。しかし、タンパク質の設計図が書かれている部分は、暗号全体の数%です。それでは、残りの配列は何をしているのでしょうか。残りの配列の一部には、タンパク質が、どの細胞でいつ・どのくらい発現するか、厳密にコントロールするための配列(制御配列)が含まれています。私達の細胞は、基本的にどの細胞でも、つまり血液の細胞でも、皮膚になる細胞でも、同じゲノムを持っています。しかし、血液の基となる細胞が、血液の細胞になれたのは、血液で必要なタンパク質だけが、必要な時期に必要な量、発現したからです。例えば、血液で重要な遺伝子の近くにはG-A-T-Aという制御配列があり、血液で働くGATA-1と呼ばれる転写因子が認識して結合します。酸素を運搬するヘモグロビンをつくるのに必要な遺伝子の近くにも、-G-A-T-A-という配列があり、GATA-1転写因子が結合して遺伝子の発現をONにしています。しかし、G-A-T-Aという配列があれば、必ずそこにGATA-1が結合して、近くの遺伝子のスイッチをONにするのかというと、そうではありません。-G-A-T-A-の配列の周辺の配列や、協力して働く別の転写因子の結合する配列があるかなどの様々な条件が整って、初めてGATA-1が機能を発揮できるようになっています。さらに最近では複数の転写因子が結合したときに、その間をつなぐような働きをする転写共役因子の重要性も指摘されるようになってきました。制御配列も含めて、私たちのゲノムの多くの部分の機能は、分かっていません。ヒトの遺伝子の解読技術が飛躍的に進んだ現在、この制御配列の解明が期待されています。
せっせと作って、いらなきゃ壊す
~酸化ストレスに素早く応答する生体防御の仕組み~
環境中には、様々な毒性物質があり、呼吸や食事で体内に取り込まれます。中には、放っておくとDNAやタンパク質などを酸化させ、様々な疾患の原因となるものがあります。これらの物質を解毒化するため、ストレス防御遺伝子が働くことが知られていますが、体内で毒性物質が悪さをする前に、素早く応答する必要があります。
細胞には、実はこのような毒性物質に対するセンサーが備わっており、Keap1タンパク質を含むタンパク質複合体でできています。Keap1が働く仕組みは次の通りです。細胞はストレスがない時から、ストレス防御遺伝子のスイッチをONにするNrf2という転写因子を合成していますが、そのほとんどはKeap1複合体によって分解されています。しかし、Keap1が毒性物質などのストレスを感知すると、Nrf2の分解は停止して、量が増加することで防御遺伝子のスイッチがONになります。普段から、使わないNrf2を合成し、Keap1複合体がすぐに分解してしまう、一見無駄とも思える方法ですが、ストレスに応答して素早く防御機構を発動させる仕組みとして、とても有効であると考えられています。
【関連リンク】
酸化ストレス防御にはたらく転写因子Nrf2の量的調節機構の解明


