ゲノムの時代へ
膨大な情報を、
わたしたちは自在にあやつって、
新しい時代を拓くことができるのか、
やがてくる明日への羅針盤に
人体を取りまく常在菌〜機能を知って共存しよう〜
ヒトの体は約30兆個※1の細胞で形成されています。それに対して体内外に生息する常在菌の数は40〜100兆個に及ぶと言われています。これらの常在菌は、私たち宿主の健康状態や生活環境と複雑に相互作用しあって、腸内や口腔内をはじめとした様々な部位で細菌の集団(細菌叢)を形成しています。食習慣の変化や抗生物質の服用などにより健康な細菌のバランスが崩れる細菌叢破綻(ディスバイオーシス)が疾患発症に関わることがあることから、疾患の仕組みを理解するためには常在細菌叢への深い理解が必要と考えられています。
これまでは、主に、採取した細菌を単離培養し、個々の細菌を生物学的にあるいは遺伝学的に同定してきました。しかし、常在細菌叢は数百種の細菌種から構成され、その中には多くの難培養性の細菌が含まれているため、細菌叢プロファイルを把握するのは困難でした。それに対して、次世代シークエンサーの登場と共に、「アンプリコン解析」と「メタゲノム全ゲノム解析」という2つの新しい解析手法が可能となり、細菌叢プロファイル把握の効率が飛躍的に上がりました。
アンプリコン解析は、どのような細菌がどのような割合で細菌叢を構成しているかを明らかにする手法です。採取したサンプルから培養を介さずに直接細菌集団のDNAをまとめて抽出し、細菌の系統学的分類の指標として用いられる16SリボソームRNA (rRNA)遺伝子の配列データを解析します。しかし、ほとんどが科もしくは属レベル※2までの同定にとどまり、正確な菌種を特定することは難しいという課題があります。ましてや、細菌ごとの性質や機能に直結する遺伝子レベルの解析にアプローチすることはできません。
一方メタゲノム全ゲノム解析は、アンプリコン解析ほど手軽ではありませんが、細菌叢の遺伝子配列を網羅的に解析することが可能です。メタゲノム全ゲノム解析では、アンプリコン解析よりさらに詳細の種レベルでの系統分類学的解析や、細菌ゲノムの構造解析、細菌のもつ代謝経路の解析などが可能になります。また、このデータとともに代謝物(メタボローム)や遺伝子発現(トランスクリプトーム)といった異なる階層の解析を組み合わせたオミックス解析の有用性も示されてきています。
このように、細菌叢の組成のみならず、それぞれの細菌の性質と機能を明らかにするための細菌遺伝子の配列情報の詳細な解析にも注目が集まっています。現在は、アンプリコン解析とメタゲノム全ゲノム解析を使い分けて常在菌の解析が行われています。
宿主であるヒト自身の遺伝子型のみならず、共生する常在菌の遺伝子型も疾患の発症や予後を予測するマーカーとなり得る可能性があり、常在細菌叢とその遺伝子機能の理解は、共生する細菌叢のバランスを整えることで病気を防ぐ、新しい疾患予防法の開発につながるものと考えられます。
※1. ヒトの体の細胞の数には諸説あり、かつて60~100兆という推定値もありましたが、近年は37兆2000億個と言われています。
Bianconi E, at al. (2013) An estimation of the number of cells in the human body. Ann Hum Biol. 40(6):463−471.
※2. すべての生き物は界、門、目、科、属、種と細分されます。16SリボソームRNA遺伝子の解析では、多くの場合細菌を科もしくは属レベルまでの大まかな分類までしか特定することができません。
【関連リンク】
お口の中には健康のヒントがいっぱい ~日本初の大規模口腔マイクロバイオーム解析~【プレスリリース】
なぜウイルスははやく変化するのか?
風邪などの病気を引き起こすこともあり、最近は新型コロナウイルス感染症が話題となっている、ウイルス。ウイルスは変化がはやい、とか、進化がはやい、とか、すぐに形を変える、といったこと、聞いたことはないでしょうか?実際に、何がはやいのか、ゲノムの視点で見ていきましょう。
ウイルスの遺伝情報
ウイルスは、とても小さな粒子の中に、自己増殖のための遺伝情報を持っています。ウイルスは独自の遺伝情報を持っていますが、その遺伝情報を伝えるDNAやRNAを覆っている粒子を構成する部品であるタンパク質の合成を感染する宿主細胞に依存している寄生体です。
ウイルスには様々な種類があります。大きさや粒子の構造が異なるだけでなく、遺伝情報の実体とコピーの作り方まで実に様々です。遺伝情報の実体が、DNAだったりRNAだったり、一本鎖のものもあれば二本鎖のものもあります。さらに幾つかの分節に分かれたゲノムを持つウイルスもいます。ウイルスの種類によっては、粒子の外側が脂質の膜で出来たエンベロープで包まれており、そこにはウイルス独自のタンパク質が埋め込まれています。よく話題にあがるインフルエンザウイルス、エイズウイルス、そしてコロナウイルスは、いずれも一本鎖のRNAのゲノムを持つウイルスで、外側はエンベロープで包まれていますが、それぞれで異なる特徴をもっています。インフルエンザウイルスは分節型のゲノムを持っています。違う分節どうしが交錯するなどして、組み合わせが変わってしまうことがあります。エイズウイルスはゲノムのRNAからDNAを合成すること(逆転写)を介した増殖を行うために突然変異の発生率が高いとされています。一方、コロナウイルスはゲノムRNAがそのままmRNAの機能を果たして、タンパク質合成に使われています。
ウイルスの遺伝情報の変化
インフルエンザウイルスで起こりやすい分節の組み合わせの変化や、エイズウイルスでの逆転写の際の突然変異の発生率の高さは、ウイルスの遺伝情報の変わりやすさにつながります。
ウイルスの遺伝情報の変化のはやさは、ウイルスの種類によって異なるのですが、いくつかの共通する理由があり、特にRNAを遺伝情報の実体とするウイルスではやい傾向があります。ヒトの遺伝情報の実体はDNAで、複製において塩基が取り込まれて鎖が伸長される際に、かなり精巧なエラー修復機構があるので非常に正確です。しかし、ウイルスの場合、粒子の材料作りであるタンパク質の合成は宿主の細胞内の仕組みに依存する一方で、自分自身の遺伝情報の複製については、独自の方法でそれぞれ行っており、ウイルスの種類によってはエラーが入りやすいのです。一般に、RNAウイルスでは、ヒトゲノムの進化速度の約100万倍の規模の進化速度が、エイズウイルスやインフルエンザで報告されていて、SARSコロナウイルスについても同程度です*1。新型コロナウイルスの場合、23.1置換数/年という推定値*2が得られていますので、ゲノムサイズ(約29,900塩基)で標準化するとは、0.77 x 10-3/塩基サイト/年になります。ただし、年あたりの進化速度は、複製あたりの塩基置換率と年あたりの複製回数の積ですので、感染と増殖が活発なウイルス株は世代サイクルが速く回るために、他のウイルス株よりも進化速度の推定値が高めになる可能性があります。
なんだかウイルスは自分の設計図のコピーを粗雑に作っているように感じられるかもしれませんが、ウイルスの自己増殖のためには、自分の遺伝情報を元にタンパク質の合成を開始すること、そして設計図のコピーを作ることを素早く行うことが大事です。そして、生き残り続けるためには、変化することも大事です。ウイルスの遺伝情報の変化により性質が変わることは話題になりやすいですが、単に変化するほどウイルスの生存に有利という訳ではありません。自己増殖能力を保持するためは、自分の大切なタンパク質の基本的機能を維持する必要があります。RNAウイルスのような、サイズが小さく、精巧なエラー修復機構などのないゲノム上では、突然変異がランダムに発生することにより、自己増殖能力が損なわれるような変異が入る場合も多いと予想されます。これらは淘汰される運命にあり、ほとんど検出されません。一方で、ウイルスの遺伝情報の変化の中には、ウイルス粒子の表面の構造をわずかに変化させるものがあります。これは、ウイルスが宿主の免疫系による認識から逃れたり、宿主細胞との相互作用のあり方に変化が生じたりして、感染対象の生物種や細胞の種類を変化させることにつながる場合もあります。
ウイルスの遺伝情報のはやい変化は、ウイルスの遺伝的多様性を急速に増大させるので、治療薬の開発を困難にしたり、それらが有効に効くウイルスのタイプが限定されたり、あるいは耐性株が出現する可能性があります。一方で、特定のタイプのウイルス株のみが広く急速に感染拡大すると、感染者から単離されるウイルスの全体的な遺伝的多様性は、一時的に減少すると予想されます。新型コロナウイルスのゲノム情報が迅速に共有されていることは、ウイルスゲノムの分子進化速度の推定、および分子系統樹作成による世界各地への感染の広がり方の推測が可能になっており、感染症対策と研究開発の促進に役立っています。
参考文献
*1. hao, Z., Li, H., Wu, X. et al. Moderate mutation rate in the SARS coronavirus genome and its implications. BMC Evol Biol 4, 21 (2004). https://doi.org/10.1186/1471-2148-4-21
補足情報 http://virological.org/t/phylodynamic-analysis-176-genomes-6-mar-2020/356
*2. GISAID (Global Initiative on Sharing All Influenza Data)ウェブサイト Genomic epidemiology of novel coronavirus – Global subsampling(8月13日の閲覧時点)より
棒状で増やすか環状で増やすか―新たなシークエンサー開発―
塩基配列を調べる方法は、次世代シークエンス技術として飛躍的な進歩を遂げています。次世代シークエンス技術は、4つの塩基をどうやって見分けるか、どれだけの長さを連続して読めるか、調べたいDNAを増幅する必要があるかなどの点でさまざまな違いがあり、これらの違いがシークエンスの速さや正確さにも影響しています。
現在の主流は、目印を付けた棒状の一本鎖DNA断片をガラス板の上にくっつけて、2-4色の蛍光色素を使ってDNA配列を読んでいく方法です。棒状のDNA断片のくっついたガラス板に蛍光色素付きの塩基を流し込み、断片にくっついた色を端から順番に調べていくことで塩基配列を調べることが出来ます。ただし、断片1本1本の出す光は弱いため、カメラで蛍光を検出するためにガラス板上で1000本ほどのコピーを作らなければなりません。そこで、ガラス板についていない方の断端をガラス板にくっつけて橋を渡すようにしたあとにPCRによって断片を増やします。PCRは鋳型となる1本鎖DNAの端からペアとなる塩基をくっつけて行くことで、DNA断片を2倍に増やすことが出来ます。この反応(過程)を繰り返せばDNA断片を2倍2倍と対数増殖的に増やすことが出来るため、遺伝子解析ではPCRが広く活用されています。
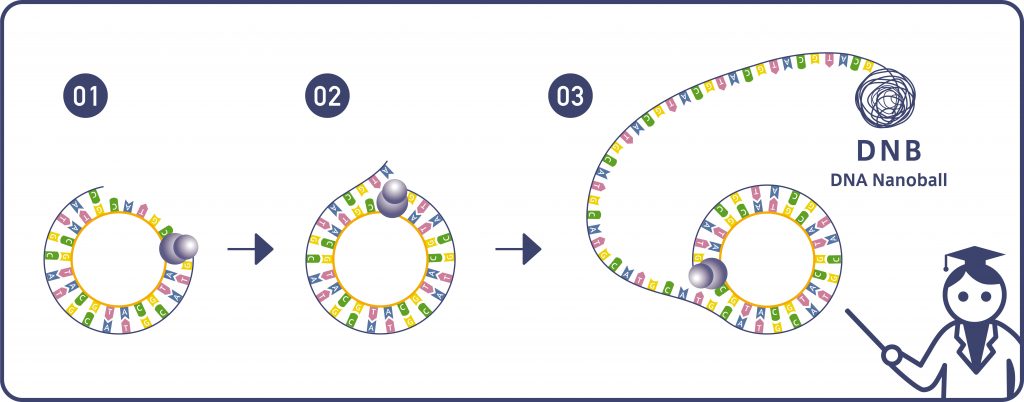
そんな中、まったく異なる原理によってDNA断片を増やす技術が開発されました。これまで活用されているPCRでは棒状のDNAを鋳型としていましたが、新しい方法ではローリングサークル型のDNA増幅を行うため、環状にしたDNAを鋳型にしています。PCRは鋳型のコピーから次のコピーを作るため、途中で入ってしまったエラーも次のコピーをつくる際に含まれてしまいます。一方、環状にしたDNA断片を使う技術では、常に最初のもともとのDNA断片を鋳型としているためこのようなことが起こらないと言われています。このコピーは環状のDNA断片の周りをグルグルと回りながらペアとなる塩基を並べていくため、1本の長い糸のようになり、この糸を再度グルグル巻きにして毛糸玉のようにします。これをDNB(DNA Nanoball)と呼んでいます。DNBには300-500のコピーが含まれ、従来の方法と同様にガラス板にくっついて光を出します。この技術を用いたシークエンサーはすでに開発のうえ販売されており、今後は、こちらの手法も活用されていくものと思われます。
遺伝子配列を読む方法は他にも多く開発されており、目的に合わせて選択されています。技術は日々躍進しています。数年後にはまた新たな手法が開発され、思いもよらなかった選択肢が広がっているかもしれません。
【関連リンク】
東北大学東北メディカル・メガバンク機構ウェブサイト 施設紹介>シークエンス解析
新型コロナウイルスに対する抗体
新型コロナウイルス(SARS-CoV-2)感染症(COVID-19、本稿では「新型コロナ」と略す)に関する報道の中で、「抗体検査」は、「PCR検査」に次ぐ頻出用語の1つとなっている。そこで、新型コロナの抗体検査に関して現時点の情報を少しご紹介したい。
詳細な解説は他書に譲るが、新型コロナに限定して説明すると、「抗体」とは、血液中などにある免疫グロブリンというタンパク質で、ウイルスやワクチンに対する免疫反応の結果産生され、ウイルス粒子の構造を認識して結合する物質である。その中で、ウイルスの増殖を抑えて、感染症からの回復や、再感染の予防に働くものを「中和抗体」と呼ぶ。
新型コロナからの回復者に関する米国と中国の報告*1*2(正式な論文発表前の情報、重症例を除く)では、ほとんどの人が回復後に抗体を保持していることが明らかにされた。特に、中国の報告では94%の人が中和抗体を持っており、感染の終息や予防に働く免疫能が獲得されたことが示されている。ただし、新型コロナウイルスと同族のウイルスには、周期的に頻繁に風邪症状を流行させるものがあり、長期的な抗体の持続については今後の検討が必要とのことであった。
また米国の報告では、抗体陽性時点でのPCR検査によるウイルスRNA陽性例が35%見られ、その一部は症状消失から約一ヶ月後の再検査でもPCR陽性であった。この結果の解釈は難しいが、血液中に抗体が存在してもウイルスが鼻腔などに長期間潜んでいる可能性も示唆された。
このように、現時点では抗体検査が陽性となっても、数ヶ月後に再度新型コロナに感染する可能性や、他の人に新型コロナを広める可能性も否定できず、受検者自身にとっての抗体検査のメリットはかなり限定的であるといわざるを得ない状況である。
一方、集団調査としての抗体検査には研究上のメリットがある。疫学研究者によると、地域の住民の60%程度が抗体を持つようになれば「社会的免疫」が成立し、その地域では新型コロナの流行は終息するとのことである。しかし、新型コロナには不顕性感染者や未診断症例が多く、発症数の統計から地域の既感染者の割合を予想することは困難である。そこで、地域の住民をできるだけ無作為に抽出して抗体検査を行い、その時点での抗体陽性者(既感染者)と抗体陰性者(未感染者)の割合を明らかにする試みが世界中で行われ、わが国でも同様の調査が予定されている。ただ残念ながら、それらの結果からは、流行の終息までには相当の時間がかかることが推測されている。
免疫には、一度出会った病原体を覚えていて次の感染を防御する反応(獲得性免疫)として、抗体(液性免疫)の他に、直接細胞が攻撃する反応(細胞性免疫)があり、さらに、初めてである病原体に対しても撃退しようとする反応(自然免疫)も存在する。新型コロナのワクチン研究では、それら全体を活性化して自然感染よりも強力な免疫を与えるワクチンの検討もなされているという。また、治療薬としても、回復者血液の抗体を製剤として治療に利用する試みや、遺伝子工学を駆使した強力な抗体製剤の開発も行われている。そのような様々な研究の成果として、そう遠くない将来に、新型コロナが過去の疾患となる日が来ることを信じたいところである。
最後に、海外では新型コロナのために予防接種全般が中断している地域もあり、麻疹などの流行が懸念されている。特にお子様がおられる家庭では、定期予防接種は可能な限り自粛せずに進めていただくことをお願いしたい。
参考文献
1. medRxiv preprint
doi: https://doi.org/10.1101/2020.04.30.20085613
2. medRxiv preprint
doi: https://doi.org/10.1101/2020.03.30.20047365
感染症の出口戦略
感染症に限らず、疾病対策の基本は費用対効果分析です。費用対効果分析とは、ある疾病を〇〇の程度減少させるためには、いったいいくらの費用がかかるのかを検討するもので、がん検診の対策立案などにも広く用いられています。費用対効果分析では「命」か「経済」かの二者択一を行うのではなく、ある効果を得ようとすると費用は必ずかかるものであるから、両者が最もバランスよく保たれるポイントを議論しようとしています。
ある疾患に関する公衆衛生学的対策の王道は以下のとおりです。
- リスクを予測する。個人のリスクおよびその疾患の広がりなどを含む
- ある対策にどれほどの効果があるのかを推定する
- 対策には常にコストや犠牲を伴うため、その対策の費用対効果を検証し、情報公開と透明な議論を経て実施有無の判断を行う
このように費用対効果分析は疾病対策の根幹を形成しています。
では費用対効果分析からみた具体的な出口戦略とはどのようなものでしょうか。まずは命、健康を守るという観点からは少なくとも以下の3つの指標を検討していかなければなりません。
1. 実効再生産数
「1人の感染者がその後何人の方に感染させるか」の指標です。1人を超えると感染者は増加し、1人を下回れば感染は終息に向かっていくと直感的に理解できます。この指標が「1」を下回ってくれば、その感染症の致死率にもよりますが、出口に近づいていると考えられます。
この実効再生産数はどのように算出されるのでしょうか。ある指標を算出するには通常、モデルというものを構築し、そこにパラメーターと呼ばれる数値を代入してその指標を導き出します。身近な例でいえば、天気予報では、数値予報モデルに世界中から送られてくる各地点の気圧、気温、風などの値を代入し、天気予報や警報の発出を行います。同じように感染症では、SEIRモデルというモデルが提唱されており、そこにパラメーターを代入し、1人の感染者がその後何人の方に感染させるのかの数値をはじき出しています。SEIRのSは感染症に対して免疫を持たない者(Susceptible)、Eは感染症が潜伏期間中の者(Exposed)、Iは発症者(Infectious)、Rは感染症から回復し免疫を獲得した者(Recovered)を指します。パラメーターとしては、以下の3つの数字が必要です。
1) 感染率
2) 潜伏期間
3) 感染期間
このパラメーターの中で、「感染率」が非常に重要な数値です。これをできるだけ正確に得るためには、感染の有無を調べるための十分な検査体制が整備され、その人が何人の方に感染させたかをつぶさに調べていくことが必要です。疾病対策の基本である実態把握のためには、当然ながら検査を受けた方の数と陽性の方の数を全国から集計し、迅速かつ正確に一元管理するシステムも必要です。未だ完備されていないのであれば、データ送信を電子化することも考慮すべきです。
また、モデルにはいくつもの種類があり、かつパラメーターも数値の採用に関していろいろな選択肢があります。その指標算出の仕方について、研究者コミュニティで議論していくことも大切な手続きと思われます。
2. 検査体制
これを整備することは感染症制御の基本です。検査をして陽性であれば、病院のみならずホテルなどもフル活用して隔離します。十分な検査体制が整備されていない状況では有病率や上記の実効再生産数などを十分な精度で算出することはできません。有病率に関しては陽性率などを代替指標として用いることもある程度は可能です。例えば、PCR検査の感度※が80%、特異度が99%、陽性率が10%である場合、有病率は0.14%と推定はできますが、感度は現時点でそれほど正確に算出されているものではなく、報告によって50%~80%くらいの幅があります。感度があやふやな段階で有病率を推定することは誤った数値を出してしまう危険があります。やはり1日当たりの検査実施数は必要かつ重要な指標の一つです。
※感度、特異度、陽性率などの用語については、日本疫学会の「新型コロナウイルス関連情報特設サイト」感染症疫学の用語解説のページの「7. 検査の正確さの指標」をご参照ください。
3. 医療体制
感染者が多くなった場合でも、重病者に対する医療体制がしっかり整備され、その受け入れ体制に余裕があれば、死亡者をある程度は減少させることができます。ある地域にはいくつの病院があり、そこには何床のベッドがあって何人の患者さんを受け入れることができるのかも、特に命を守るという観点から重要な指標です。
ここまでは命という観点からの指標をみてきました。ここからは、経済という視点からの指標をみていきます。
4. お金
感染症対策はその多くが人と人の接触を減少させる方向で実施されるものですから、どうしても経済的な損失が生じます。あまたの経済指標について、ある対策を実施した場合、どれくらいの時間が経過すると個々の指標がどれほど動くと予想されるのかを検討していくことが必要です。特に感染症では人と人が接触する可能性が高い業種ごとの経済指標に加えて、特定の業種が大きな痛手を負った場合に、マクロ経済にどのような影響があるのかも議論が必要です。対策立案には経済学者の参画は必須です。
5. もの
経済の柱のひとつである「ものづくり」にどのような影響があるのかをみなければなりません。自動車工業やパルプ・紙・紙加工品工業などの生産量はその対策によっていかほどの影響を受けているのか、食料品や日常品などはどうかなど、鉱工業指数や食料品工業指数やそれと類似した短期的な指標などのモニタリングが必要です。さらに直近の懸念としては、今必要とされているマスクや防護服などの医療や予防に使用されるべき「もの」について、供給が遅延するような事態を引き起こしていないかの確認が必要です。
6. ひと
医療関係者にかかる大きな負担は何らかの数値化を行い考慮すべきです。また、最も重要な「ひと」に関する指標のひとつには教育があります。学校を休校にするのであれば、教育という「ひと」への重要な投資が奪われるという費用(コスト)を考慮に入れなければなりません。家庭に閉じこもることで、虐待やDVなどの問題も深刻化するかもしれませんので対策が必要です。また、飲食業やホテル業などには人の心に栄養を与える効果があるのかもしれません。これを指標化するのはなかなか難しいですが、いずれにしても一律に不要不急だからいつまでも休業していいというものではないと思われます。それぞれの職業にはそれぞれの重要性があります。「ひと」を育てるあるいは癒すといった効果についても要検討とすべき指標です。これは特定の業種の収入減という指標とともに考慮されるべきものと思われます。
出口戦略の在り方
以上みてきたように、命に関しては1~3の指標を算出し、経済に関しては4~6の指標に鑑み、両者同時に並べて入口戦略と出口戦略を検討します。1~3の命に関する指標については、ひとつの対策が他の対策の効果を相乗的に上昇させることもありますし、経済に関する指標においても、失業・減収などから命や健康の問題にまた直結することもあります。要は1~6は常に有機的に影響し合っていることを念頭においておくことが必要です。また、行動変容には「脅し」手法はあまり有効ではなく、シンプルなメッセージと自然と入ってくるものである必要があることもこれまでの延々と続けられてきた公衆衛生対策で明らかとなっています。「人の行動はおいそれとは変わらない」ことを前提に対策を検討します。出口戦略としては、命に関する1~3の指標がすべてある閾値を下回るあるいは越えて青信号となり、かつ経済に関する4~6の指標すべてが赤信号になった場合には、おそらく躊躇なく出口である休業要請解除に進む判断が下されますが、現実には6つの指標が赤、黄色、青の入り混じった状態になります。指標群はこのような状態であるが、何を重視し、何を守ることが費用対効果の観点から最も賢明であるかを判断し、段階的に〇〇のような解除を行っていくという決定に至ります。この過程で重要なことは、それぞれの指標がどのように算出されてきたのか、出てきた指標群をどのように議論したのかを十分に公開し、さらに国民に向かって丁寧に説明していくことです。最終的にどのような出口戦略であっても、万人の利益が最大化されることはなかなか困難で、身体が弱い方にとっては早期の解除は命に係わると思われるでしょうし、休業要請が長引く業種の方々にとっては、経済的に命を失うと思われるでしょう。したがって、入口である対策の決定を行ったのであれば、そのことで相対的に大きな損失を被ることになる方々には公的資金で補償をするあるいは家庭内における虐待やDVに関する対策が必要ですし、出口においては命に関わるリスクが高くなる方々に、自治体の保健師さんなどがより活動しやすくなるような措置が必要です。費用対効果分析で全体の戦略を描いて実行した後は、そこで大きなしわ寄せを受ける方々に必要な施策を実施していくことが求められます。また、ワクチンや治療薬の開発が実現された場合、あるいは逆に感染の第2波等が襲来した場合には、すみやかにその時点の数値で費用対効果分析を行い、遅滞なく対策を柔軟に修正することが重要です。