ゲノムの時代へ
膨大な情報を、
わたしたちは自在にあやつって、
新しい時代を拓くことができるのか、
やがてくる明日への羅針盤に
なぜウイルスははやく変化するのか?
風邪などの病気を引き起こすこともあり、最近は新型コロナウイルス感染症が話題となっている、ウイルス。ウイルスは変化がはやい、とか、進化がはやい、とか、すぐに形を変える、といったこと、聞いたことはないでしょうか?実際に、何がはやいのか、ゲノムの視点で見ていきましょう。
ウイルスの遺伝情報
ウイルスは、とても小さな粒子の中に、自己増殖のための遺伝情報を持っています。ウイルスは独自の遺伝情報を持っていますが、その遺伝情報を伝えるDNAやRNAを覆っている粒子を構成する部品であるタンパク質の合成を感染する宿主細胞に依存している寄生体です。
ウイルスには様々な種類があります。大きさや粒子の構造が異なるだけでなく、遺伝情報の実体とコピーの作り方まで実に様々です。遺伝情報の実体が、DNAだったりRNAだったり、一本鎖のものもあれば二本鎖のものもあります。さらに幾つかの分節に分かれたゲノムを持つウイルスもいます。ウイルスの種類によっては、粒子の外側が脂質の膜で出来たエンベロープで包まれており、そこにはウイルス独自のタンパク質が埋め込まれています。よく話題にあがるインフルエンザウイルス、エイズウイルス、そしてコロナウイルスは、いずれも一本鎖のRNAのゲノムを持つウイルスで、外側はエンベロープで包まれていますが、それぞれで異なる特徴をもっています。インフルエンザウイルスは分節型のゲノムを持っています。違う分節どうしが交錯するなどして、組み合わせが変わってしまうことがあります。エイズウイルスはゲノムのRNAからDNAを合成すること(逆転写)を介した増殖を行うために突然変異の発生率が高いとされています。一方、コロナウイルスはゲノムRNAがそのままmRNAの機能を果たして、タンパク質合成に使われています。
ウイルスの遺伝情報の変化
インフルエンザウイルスで起こりやすい分節の組み合わせの変化や、エイズウイルスでの逆転写の際の突然変異の発生率の高さは、ウイルスの遺伝情報の変わりやすさにつながります。
ウイルスの遺伝情報の変化のはやさは、ウイルスの種類によって異なるのですが、いくつかの共通する理由があり、特にRNAを遺伝情報の実体とするウイルスではやい傾向があります。ヒトの遺伝情報の実体はDNAで、複製において塩基が取り込まれて鎖が伸長される際に、かなり精巧なエラー修復機構があるので非常に正確です。しかし、ウイルスの場合、粒子の材料作りであるタンパク質の合成は宿主の細胞内の仕組みに依存する一方で、自分自身の遺伝情報の複製については、独自の方法でそれぞれ行っており、ウイルスの種類によってはエラーが入りやすいのです。一般に、RNAウイルスでは、ヒトゲノムの進化速度の約100万倍の規模の進化速度が、エイズウイルスやインフルエンザで報告されていて、SARSコロナウイルスについても同程度です*1。新型コロナウイルスの場合、23.1置換数/年という推定値*2が得られていますので、ゲノムサイズ(約29,900塩基)で標準化するとは、0.77 x 10-3/塩基サイト/年になります。ただし、年あたりの進化速度は、複製あたりの塩基置換率と年あたりの複製回数の積ですので、感染と増殖が活発なウイルス株は世代サイクルが速く回るために、他のウイルス株よりも進化速度の推定値が高めになる可能性があります。
なんだかウイルスは自分の設計図のコピーを粗雑に作っているように感じられるかもしれませんが、ウイルスの自己増殖のためには、自分の遺伝情報を元にタンパク質の合成を開始すること、そして設計図のコピーを作ることを素早く行うことが大事です。そして、生き残り続けるためには、変化することも大事です。ウイルスの遺伝情報の変化により性質が変わることは話題になりやすいですが、単に変化するほどウイルスの生存に有利という訳ではありません。自己増殖能力を保持するためは、自分の大切なタンパク質の基本的機能を維持する必要があります。RNAウイルスのような、サイズが小さく、精巧なエラー修復機構などのないゲノム上では、突然変異がランダムに発生することにより、自己増殖能力が損なわれるような変異が入る場合も多いと予想されます。これらは淘汰される運命にあり、ほとんど検出されません。一方で、ウイルスの遺伝情報の変化の中には、ウイルス粒子の表面の構造をわずかに変化させるものがあります。これは、ウイルスが宿主の免疫系による認識から逃れたり、宿主細胞との相互作用のあり方に変化が生じたりして、感染対象の生物種や細胞の種類を変化させることにつながる場合もあります。
ウイルスの遺伝情報のはやい変化は、ウイルスの遺伝的多様性を急速に増大させるので、治療薬の開発を困難にしたり、それらが有効に効くウイルスのタイプが限定されたり、あるいは耐性株が出現する可能性があります。一方で、特定のタイプのウイルス株のみが広く急速に感染拡大すると、感染者から単離されるウイルスの全体的な遺伝的多様性は、一時的に減少すると予想されます。新型コロナウイルスのゲノム情報が迅速に共有されていることは、ウイルスゲノムの分子進化速度の推定、および分子系統樹作成による世界各地への感染の広がり方の推測が可能になっており、感染症対策と研究開発の促進に役立っています。
参考文献
*1. hao, Z., Li, H., Wu, X. et al. Moderate mutation rate in the SARS coronavirus genome and its implications. BMC Evol Biol 4, 21 (2004). https://doi.org/10.1186/1471-2148-4-21
補足情報 http://virological.org/t/phylodynamic-analysis-176-genomes-6-mar-2020/356
*2. GISAID (Global Initiative on Sharing All Influenza Data)ウェブサイト Genomic epidemiology of novel coronavirus – Global subsampling(8月13日の閲覧時点)より
ゲノムの変異の実験的効果予測 ~BRCA1タンパク質の機能測定からみえるもの~
図を拡大
 ヒトゲノム全体が解読されてから、現在ではゲノムの多様性を解明する研究が盛んに進められています。メンデル遺伝性疾患の場合、原因遺伝子に観察されるそれぞれのバリアントが、疾患の原因となるのかどうかを判断することはとても重要です。これまでの研究で報告されている病的バリアント(疾患の原因となるバリアント)の情報はデータベースに蓄積されてきているので、着目するバリアントが病的バリアントであるか、あるいはその可能性が高いと報告されているものかどうかを確認することは、専門家により広く行われています。しかしヒト集団中には、本当は疾患原因のバリアントであっても、まだ論文などで報告されていないものも存在しますし、人が世代交代を続けている以上、突然変異により新たなバリアントが発生します。では、どうすればより良い判断ができるでしょうか?
ヒトゲノム全体が解読されてから、現在ではゲノムの多様性を解明する研究が盛んに進められています。メンデル遺伝性疾患の場合、原因遺伝子に観察されるそれぞれのバリアントが、疾患の原因となるのかどうかを判断することはとても重要です。これまでの研究で報告されている病的バリアント(疾患の原因となるバリアント)の情報はデータベースに蓄積されてきているので、着目するバリアントが病的バリアントであるか、あるいはその可能性が高いと報告されているものかどうかを確認することは、専門家により広く行われています。しかしヒト集団中には、本当は疾患原因のバリアントであっても、まだ論文などで報告されていないものも存在しますし、人が世代交代を続けている以上、突然変異により新たなバリアントが発生します。では、どうすればより良い判断ができるでしょうか?
この課題へのアプローチの仕方は一つではないのですが、最近、ゲノム編集技術を活用した画期的な論文が発表されました※。遺伝性乳癌卵巣癌症候群の原因遺伝子の一つとしてBRCA1が知られていますが、この研究では、BRCA1タンパク質の機能的に重要な部分の塩基配列について、あり得る全ての一塩基変異のゲノム編集実験を行いました。そして、BRCA1タンパク質が本来の機能を発揮しているかどうかを、細胞の生き残りの程度で計測しました。実際に、約4,000の一塩基変異の機能への効果を測定し、その分布は二峰性を示すことが分かりました。機能測定の結果の分析により、それぞれの変異が病因性をもつかどうかという予測について、有効な手法であることが分かりました。
この研究の手法は、他の重要な機能をもつ遺伝子についても適用できることはもちろん、得られたデータから見えてくることは、遺伝医学的側面のみならず、タンパク質の機能を保ちながら変異できる範囲など、基礎研究においてもインパクトが大きいと考えられます。また、実験的な変異の効果予測は、近い将来の詳細な研究の蓄積を先回りしているところがあり、バリアントの解釈方法の進展が加速していくことを示しています。これまでは、効果の不明なバリアントが沢山残っていたところ、本研究のような手法により得られた知見を活用することで、病的バリアントがどれであるかの判断がしやすくなるので、ゲノムに基づく個別化医療・予防の精度が高まることが期待されます。
※ 参考文献
Accurate classification of BRCA1 variants with saturation genome editing | Findlay GM, et al. | Nature 562(7726):217-222, 2018. | doi: 10.1038/s41586-018-0461-z
動く遺伝因子とトウモロコシ ~深ーい研究の歴史と現在~
図を拡大
 みなさん、トウモロコシは好きですか?日本で食用として売られているトウモロコシの実の色は、たいてい黄色一色か、あるいは時々白い粒が混じっている程度ですが、一粒一粒それぞれが、めしべ(絹糸)に受粉してできた子どもたちなのです!トウモロコシ(イネ科の植物)は種類によっては、紫色が出るものもあったりして、一粒一粒それぞれが個性を持っています。遺伝と聞くと、親から継承されるもので、組み換えや稀な突然変異以外では変わらないもの、というイメージがあるかもしれません。
みなさん、トウモロコシは好きですか?日本で食用として売られているトウモロコシの実の色は、たいてい黄色一色か、あるいは時々白い粒が混じっている程度ですが、一粒一粒それぞれが、めしべ(絹糸)に受粉してできた子どもたちなのです!トウモロコシ(イネ科の植物)は種類によっては、紫色が出るものもあったりして、一粒一粒それぞれが個性を持っています。遺伝と聞くと、親から継承されるもので、組み換えや稀な突然変異以外では変わらないもの、というイメージがあるかもしれません。
ところがじつは、ゲノムの中には「動く遺伝因子」があり、トランスポゾンと総称されています。トランスポゾンは特定のDNA断片を切り出し、別の場所に再挿入することで移動します。植物の形態や花の色の変化には、トランスポゾンの転移によるものがあります。トウモロコシの一粒の中にも、トランスポゾンが転移することで、色素産生に携わる遺伝子の発現が変化し、その結果、色の違う細胞群が生じることによって見た目には色のまだらとして観察されます。 この動く遺伝因子の発見とそれが世に認められるまで、バーバラ・マクリントックという1人の女性研究者抜きには語れません。(詳細は下記)
ヒトのゲノムにも、動く遺伝因子がありまして、レトロトランスポゾンと呼ばれる種類です。遺伝子領域にレトロトランスポゾンが挿入されることによって、遺伝子が本来の機能を発揮できず、疾患の原因になることもあります。これまでに、血友病、先天性の疾患各種、がんなど、レトロトランスポゾンの挿入が疾患の原因と考えられる例が120以上報告されています。
バーバラ・マクリントック(1902-1992)
バーバラ・マクリントックは、アメリカで活躍した細胞遺伝学者で、トウモロコシを主な実験対象としていました。1920-30年代の遺伝学の研究では、複数の形質と染色体を観察することによって、形質に関わる遺伝因子が染色体上にどのように並んでいるかの地図作りのようなことが進んでいまして、バーバラ・マクリントックは植物遺伝学において大きな貢献をしました。その後、1940年代から数年かけた注意深い研究により、動く遺伝因子があることを発表しました(1950-51年)。それはなんと、DNAの二重らせん構造の発表(1953年)よりも少し前のことだったのです! そしてずいぶん年月が経った1983年に、バーバラ・マクリントックは、ノーベル医学生理賞を受賞しました。
農業的に重要な栽培植物であるトウモロコシの全ゲノムは、2009年に解読が発表され、ゲノム中のトランスポゾンの全貌も明らかになりました。現在では、全ゲノム解読データや生命現象の網羅的なデータが得られるようになりました。しかしこのような現代の状況で、研究の歴史をたどってみると、バーバラ・マクリントックという先駆者が、注意深い観察と深い洞察により、ゲノムのダイナミックな側面に気づいた、ということは、数々の発見や発展の中の大事な一つとして、とても印象深いことです。
参考文献:
Science (2009) 326:5956 1112-1115 DOI: 10.1126/science.1178534
Mobile DNA (2016) 7:9. doi:10.1186/s13100-016-0065-9.
その遺伝子、ない方がマシ?
図を拡大
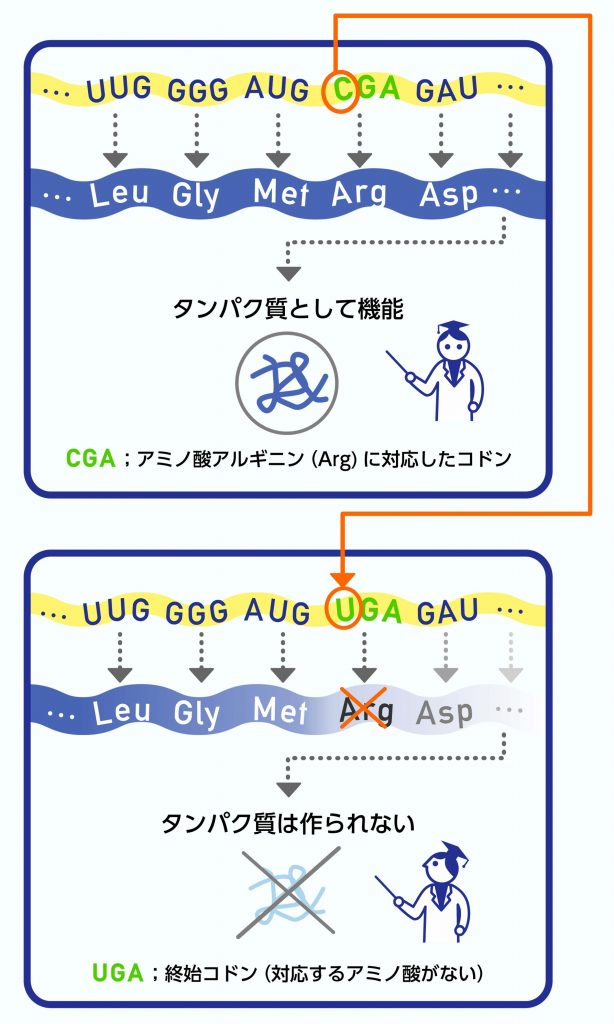 遺伝子の塩基配列のタンパク質をコードする部分の途中に予期せぬ終止コドンが入ってしまうと、遺伝子産物に重大な影響があります。実際、疾患の原因として知られているバリアントの中には、終止コドンを生じさせるものが沢山含まれています。しかし、ゲノム中の終止コドンを生じさせるバリアントは、疾患などの重大な効果を持つものばかりではありません。
遺伝子の塩基配列のタンパク質をコードする部分の途中に予期せぬ終止コドンが入ってしまうと、遺伝子産物に重大な影響があります。実際、疾患の原因として知られているバリアントの中には、終止コドンを生じさせるものが沢山含まれています。しかし、ゲノム中の終止コドンを生じさせるバリアントは、疾患などの重大な効果を持つものばかりではありません。
ヒトの遺伝子セットの中には、「多重遺伝子族」といって、起源を同じくしてメンバーの間ではアミノ酸配列が似通っている遺伝子族があります。なので、多重遺伝子族においては、一つの遺伝子が機能しなくても、同じ遺伝子族の他のメンバーが機能を補ってくれる場合もありますし、機能が多様化している場合もあります。
カスペース12という遺伝子は、ヒトでは11番染色体にありますが、じつは大部分の人はこの遺伝子の活性型を持たないのです。アフリカの人々の間では、タンパク質の全長が作られる活性型と、途中で終止コドンが入ることよる不活性型が共存します。一方でアフリカ以外に住む人々では、ほぼ不活性型ばかりです。カスペース12については、活性型を持つことによって、細菌の毒素への対応能力が低下することが示されていまして、敗血症の罹りやすさを高めたではないかと考えられています。カスペース12の不活性型が広まったのは、敗血症に抵抗性があったのではないか、と推測されています。
ヒトの遺伝子セットの中には、無くても大丈夫な遺伝子があります。ときには無い方が生き延びるのに有利なこともある、という考えが提唱されています。この仮説は、less is more(ない方がマシ) 仮説という、興味深い名前が付いています。進化の過程で、生物が持つ遺伝子の数は少々増えたり減ったりしています。ゲノム上に遺伝子が存在しても、不活性型のバリアントも持つ人もいるので、ほんとうに機能している遺伝子のセットには個人差が少々あります。多重遺伝子族は、生物進化における新しい機能の獲得において重要です。一方で、機能が多様化したためか、場合によっては有難くない働きをしてしまうこともあるようですね。
■カスペース(カスパーゼともいう)ファミリーとは?
システインプロテアーゼの一種で、標的となるタンパク質のアスパラギン残基のうしろを切断するので、Cystein-ASPartic-acid-proteASEを略して、caspase(カスペース)と名付けられました。他のカスパーゼを標的として、特定のアミノ酸の並びを認識して切断して活性化させ、連鎖的な増幅によって機能します。カスペースのメンバーの多くは、細胞死の誘導に関与していますが、中には炎症の誘導や免疫系の調節に関係するものもあります。
参考文献:
Olson MV. Am J Hum Genet. 1999 Jan;64(1):
Saleh et al. Nature.2004 429, 75-79
Xue Y et al.,Am J Hum Genet. 2006 Apr;78(4):659-70
耳垢のカサカサ、ネバネバを決める遺伝子の多型
図を拡大
 耳垢のタイプには、かさかさしたタイプ(乾型)とネバネバしたタイプ(湿型)があり、それがメンデル遺伝することが昔から知られていました。しかし、どの遺伝子が耳垢のタイプに関わるのかについては、分かるのに年月がかかりました。
耳垢のタイプには、かさかさしたタイプ(乾型)とネバネバしたタイプ(湿型)があり、それがメンデル遺伝することが昔から知られていました。しかし、どの遺伝子が耳垢のタイプに関わるのかについては、分かるのに年月がかかりました。
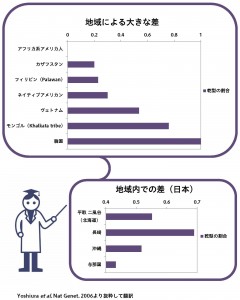
ついに2006年にToMMoの富田博秋 教授(予防医学・疫学部門)も在籍していた長崎大学のグループが、16番染色体上のABCC11 (ATP-binding cassette protein C11)という遺伝子が耳垢のタイプを決めることを突き止めました。そして、耳垢の乾型と湿型の違いは、ゲノム上のグアニン(G)またはアデニン(A)という一塩基多型(SNP)によることが分かりました。そのSNPは、ABCC11遺伝子の産物の180番目のアミノ酸のところで、グリシンまたはアルギニンという違いを生み出します。この箇所の遺伝子型がAAの人の耳垢は乾型に、一方でGAまたはGGの人は湿型になります。
ヨーロッパやアフリカの人々では、ほとんどが湿型で、乾型を決めるAのタイプは、日本を含む北東アジアに多く分布しており、その頻度は国内でも少しずつ異なっており、地理的な勾配があります。このように、遺伝子を調べていくと、意外な形で、人体の不思議や人間の成り立ちが明らかになっていくということもよく起こります。
【研究の裏話-富田博秋 教授(予防医学・疫学部門)】
私も在籍していた長崎大学の研究グループは、ヨーイドンで急に体を動かそうとすると、意に反して手足が勝手に動いてしまう「発作性運動誘発性コレオアテトーシス」の原因遺伝子が16番目の染色体の真ん中あたりにあることを突き止めていたのですが、家族性にこの症状のみられる方から、この症状がある人とない人とで耳垢のタイプが異なるというご家族のお話を伺いました。
耳垢の遺伝子も同じ場所にあるかも知れないということで、2002年、耳垢のタイプが異なる人の家系を調べて、やはり16番染色体上にあることと、その細かい場所を突き止めました。そして、2006年、その場所にあるABCC11遺伝子が耳垢のタイプを決めることを突き止めるに至りました。
参考文献:Yoshiura et al., Nat Genet. 2006.
【関連リンク】
富田教授のインタビュ― ”精神疾患、その原因を追い求めて”
最新記事一覧
-
- きこえと遺伝子医療の現在
- 2025.12.26|宇佐美真一
-
- 人体を取りまく常在菌〜機能を知って共存しよう〜
- 2020.12.16|後藤まき
-
- なぜウイルスははやく変化するのか?
- 2020.09.08|山口由美
-
- 棒状で増やすか環状で増やすか―新たなシークエンサー開発―
- 2020.07.16|川嶋順子
-
- 新型コロナウイルスに対する抗体
- 2020.05.18|峯岸直子
