ゲノムの時代へ
膨大な情報を、
わたしたちは自在にあやつって、
新しい時代を拓くことができるのか、
やがてくる明日への羅針盤に
なぜウイルスははやく変化するのか?
風邪などの病気を引き起こすこともあり、最近は新型コロナウイルス感染症が話題となっている、ウイルス。ウイルスは変化がはやい、とか、進化がはやい、とか、すぐに形を変える、といったこと、聞いたことはないでしょうか?実際に、何がはやいのか、ゲノムの視点で見ていきましょう。
ウイルスの遺伝情報
ウイルスは、とても小さな粒子の中に、自己増殖のための遺伝情報を持っています。ウイルスは独自の遺伝情報を持っていますが、その遺伝情報を伝えるDNAやRNAを覆っている粒子を構成する部品であるタンパク質の合成を感染する宿主細胞に依存している寄生体です。
ウイルスには様々な種類があります。大きさや粒子の構造が異なるだけでなく、遺伝情報の実体とコピーの作り方まで実に様々です。遺伝情報の実体が、DNAだったりRNAだったり、一本鎖のものもあれば二本鎖のものもあります。さらに幾つかの分節に分かれたゲノムを持つウイルスもいます。ウイルスの種類によっては、粒子の外側が脂質の膜で出来たエンベロープで包まれており、そこにはウイルス独自のタンパク質が埋め込まれています。よく話題にあがるインフルエンザウイルス、エイズウイルス、そしてコロナウイルスは、いずれも一本鎖のRNAのゲノムを持つウイルスで、外側はエンベロープで包まれていますが、それぞれで異なる特徴をもっています。インフルエンザウイルスは分節型のゲノムを持っています。違う分節どうしが交錯するなどして、組み合わせが変わってしまうことがあります。エイズウイルスはゲノムのRNAからDNAを合成すること(逆転写)を介した増殖を行うために突然変異の発生率が高いとされています。一方、コロナウイルスはゲノムRNAがそのままmRNAの機能を果たして、タンパク質合成に使われています。
ウイルスの遺伝情報の変化
インフルエンザウイルスで起こりやすい分節の組み合わせの変化や、エイズウイルスでの逆転写の際の突然変異の発生率の高さは、ウイルスの遺伝情報の変わりやすさにつながります。
ウイルスの遺伝情報の変化のはやさは、ウイルスの種類によって異なるのですが、いくつかの共通する理由があり、特にRNAを遺伝情報の実体とするウイルスではやい傾向があります。ヒトの遺伝情報の実体はDNAで、複製において塩基が取り込まれて鎖が伸長される際に、かなり精巧なエラー修復機構があるので非常に正確です。しかし、ウイルスの場合、粒子の材料作りであるタンパク質の合成は宿主の細胞内の仕組みに依存する一方で、自分自身の遺伝情報の複製については、独自の方法でそれぞれ行っており、ウイルスの種類によってはエラーが入りやすいのです。一般に、RNAウイルスでは、ヒトゲノムの進化速度の約100万倍の規模の進化速度が、エイズウイルスやインフルエンザで報告されていて、SARSコロナウイルスについても同程度です*1。新型コロナウイルスの場合、23.1置換数/年という推定値*2が得られていますので、ゲノムサイズ(約29,900塩基)で標準化するとは、0.77 x 10-3/塩基サイト/年になります。ただし、年あたりの進化速度は、複製あたりの塩基置換率と年あたりの複製回数の積ですので、感染と増殖が活発なウイルス株は世代サイクルが速く回るために、他のウイルス株よりも進化速度の推定値が高めになる可能性があります。
なんだかウイルスは自分の設計図のコピーを粗雑に作っているように感じられるかもしれませんが、ウイルスの自己増殖のためには、自分の遺伝情報を元にタンパク質の合成を開始すること、そして設計図のコピーを作ることを素早く行うことが大事です。そして、生き残り続けるためには、変化することも大事です。ウイルスの遺伝情報の変化により性質が変わることは話題になりやすいですが、単に変化するほどウイルスの生存に有利という訳ではありません。自己増殖能力を保持するためは、自分の大切なタンパク質の基本的機能を維持する必要があります。RNAウイルスのような、サイズが小さく、精巧なエラー修復機構などのないゲノム上では、突然変異がランダムに発生することにより、自己増殖能力が損なわれるような変異が入る場合も多いと予想されます。これらは淘汰される運命にあり、ほとんど検出されません。一方で、ウイルスの遺伝情報の変化の中には、ウイルス粒子の表面の構造をわずかに変化させるものがあります。これは、ウイルスが宿主の免疫系による認識から逃れたり、宿主細胞との相互作用のあり方に変化が生じたりして、感染対象の生物種や細胞の種類を変化させることにつながる場合もあります。
ウイルスの遺伝情報のはやい変化は、ウイルスの遺伝的多様性を急速に増大させるので、治療薬の開発を困難にしたり、それらが有効に効くウイルスのタイプが限定されたり、あるいは耐性株が出現する可能性があります。一方で、特定のタイプのウイルス株のみが広く急速に感染拡大すると、感染者から単離されるウイルスの全体的な遺伝的多様性は、一時的に減少すると予想されます。新型コロナウイルスのゲノム情報が迅速に共有されていることは、ウイルスゲノムの分子進化速度の推定、および分子系統樹作成による世界各地への感染の広がり方の推測が可能になっており、感染症対策と研究開発の促進に役立っています。
参考文献
*1. hao, Z., Li, H., Wu, X. et al. Moderate mutation rate in the SARS coronavirus genome and its implications. BMC Evol Biol 4, 21 (2004). https://doi.org/10.1186/1471-2148-4-21
補足情報 http://virological.org/t/phylodynamic-analysis-176-genomes-6-mar-2020/356
*2. GISAID (Global Initiative on Sharing All Influenza Data)ウェブサイト Genomic epidemiology of novel coronavirus – Global subsampling(8月13日の閲覧時点)より
公衆衛生対策を後押しするゲノム情報 -新型コロナウイルス感染症クラスター対策の視点から-
現在、世界中で流行が拡大している新型コロナウイルス感染症(Novel Coronavirus disease 2019: COVID-19)。その原因となるのが新型コロナウイルス (SARS-CoV-2) です。SARS-CoV-2を含むコロナウイルスは、外側を膜(エンベロープ)で覆っているエンベロープウイルスです。ウイルスのゲノムはRNAで、約3万塩基とRNAのゲノムを持つウイルスの中でも最長です。ウイルス粒子は直径 約100-200 nmで、S (スパイク)、M (マトリックス)、E (エンベロープ)という3つのタンパク質で構成されています。ウイルスは、相手に感染しようとするとき、その相手の細胞のとっかかりのようなもの(受容体)を見つけて、結合してから細胞に入り込みます。ウイルスの側で、その受容体と結合するのはSタンパク質です。Sタンパク質が鍵ならば、細胞の受容体が鍵穴になります*1。ヒトに感染するコロナウイルスとしては、風邪の原因ウイルスとしてヒトコロナウイルス229E、OC43、NL63、HKU-1の4種類、そして、重篤な肺炎を引き起こす2002年に発生した重症急性呼吸器症候群 (SARS)コロナウイルスと2012年に発生した中東呼吸器症候群 (MERS)コロナウイルスの2種類が知られています*2。SARS-CoV-2は、相同性約80%とSARSコロナウイルスに近く、SARSコロナウイルスと同じ受容体 (ACE2)を使ってヒトの細胞に吸着・侵入することが最近の研究で報告されています*1。
日本においては、2019年末の中国・武漢を発端とするSARS-CoV-2が2020年1⽉から2⽉にかけて国内に流入し、地域的な感染クラスター(集団)を発⽣させました。クラスターが発⽣した場所では「積極的疫学調査」(感染症などの色々な病気について、発生した集団感染の全体像や病気の特徴などを調べることで、今後の感染拡大防止対策に用いることを目的として行われる調査)が実施され、発⽣源と濃厚接触者を特定することで、さらなる感染拡⼤を封じ込める対策が展開されてきました。一時的に⼀定の成果を得た地域もありますが、後に各地で感染拡⼤が進⾏し、2020年4月28日現在で全国規模の緊急事態宣⾔に⾄っています。
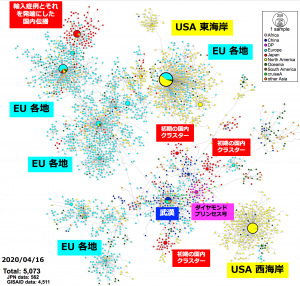
感染拡大の状況を把握し、今後の対策を立てる上で積極的疫学調査は重要ですが、それを裏付け科学的に支援するのがゲノム情報です。世界各地の研究所においてSARS-CoV-2のゲノム配列が解読されており、4月16日現在で4,511人から採取した検体のSARS-CoV-2ゲノム配列がGlobal lnitiative on Sharing All Influenza Data:GISAIDのデータベースに登録されています。日本国内でもSARS-CoV-2のゲノム解読は進められています。4月27日、国立感染症研究所からSARS-CoV-2に関する分子疫学調査の結果が発表*3されました。日本国内で各地の協力施設から収集された陽性者の検体を用いて562患者でのゲノム解読が行われ、世界のデータと統合した塩基変異抽出、ウイルス株の親子関係を示すハプロタイプネットワーク図が作成され、その分析結果が解説されています。SARS-CoV-2の変異速度は現在のところ25.9塩基変異/ゲノム/年(つまり、1年間で25.9箇所の変異が⾒込まれる)と推定*4されています。2019年末の発⽣から4ヶ⽉ほどの期間を経て、ゲノム全域に少なくとも9塩基ほどの変異がランダムに発⽣していると⽰唆されています。
日本では、中国発の第1波においては “中国、湖北省、武漢” をキーワードに感染者を特定し、濃厚接触者をいち早く探知して抑え込むことができていました。しかし、緻密な疫学調査により収束へと導くことができるかと思われた矢先に、3⽉中旬から全国各地で “感染経路(リンク)不明” の孤発例が検出されはじめています。渡航⾃粛が始まる3⽉中旬までに海外からの帰国者経由で “第2波” の流⼊を許し、数週間のうちに全国各地へ伝播して “渡航歴なし・リンク不明” の患者・無症状病原体保有者が増加したこと、3⽉中旬以降、国内移動や外出自粛などの⾏動制限の徹底がなかなか出来なかったことで、SARS-CoV-2が国内に徐々に広まり、現在の感染拡⼤へ繋がったと推測されています。今後、第3波、第4波が来ることは十分に考えられます。ゲノム情報と疫学調査情報の迅速な共有、公開が効果的な感染症対策の鍵と言えるでしょう。
参考文献
1. 日本ウイルス学会「新型コロナウイルス感染症について」
2. Cui, J., Li, F., Shi, Z.L. Origin and evolution of pathogenic coronaviruses. Nat. Rev. Microbiol. 2019. 17181-192
3. 国立感染症研究所病原体ゲノム解析研究センター. 「新型コロナウイルスSARS-CoV-2のゲノム分子疫学調査」
4. 変異速度の推定値は、最新の成果をもとに随時更新されています。最新のデータは、Nextstrain等をご参照下さい。
“スティグマ”を避けるには~感染症の流行で、そしてゲノム研究でも
「スティグマを避けよう」という言葉、聞いたことがありますか?
新型コロナウイルスの感染拡大を受けて、スティグマを避けよう、という声が上がっています。“スティグマ”、日常ではあまり聞きなれない言葉ですが、英単語の直訳では、汚名・烙印といった意味になります。もともとは奴隷や家畜に押された焼印に由来し、キリストが十字架で受けた傷あとなども指す言葉とされます。
さて、現在、問題にされているのは社会的スティグマです。社会において、何らかの属性を持つことから差別や偏見の対象として扱われてしまうようになることを指します。属性は、民族や外見、障害などであることもあり、あるいは、何らかの疾患の罹患ということもあります。
本稿執筆現在(2020年4月23日)、新型コロナウイルスの感染拡大の局面で、問題になっているのは、ウイルス感染や、それに少しでも関係することが、そのスティグマの対象となっている事態が懸念されていることです。実際、感染者を出した機関の職員等が、各種サービスの利用を拒絶されたりする、といった事態が発生しているという報道があります。保育園利用や入店を断るといった対応は、相手を根拠なしに接触するべきでないとするというスティグマ=烙印を押していることになります。こうした差別的な扱いがあってはなりません。
また、スティグマを避けることは、差別があってはならないということに加えて、寧ろ感染拡大を防ぐためにも重要になります。不必要に感染者を叩くようなことは、人々が感染について明らかにしづらくなったり、感染経路について秘匿するようになったりといったことに繋がります。
実はゲノム研究においても、スティグマを避けることは大きなテーマであり続けています。特定の家系から特定の疾患が多くあらわれる、特定の地域で遺伝性の疾患が多い傾向がある、といったことは、科学的事実であっても、そうしたスティグマに結びつきやすいものです。研究に際して、また、発表に際して、さまざまな配慮を行って、科学的な解明と、社会的な行動等との負の結びつきを断っていこうという努力がなされています。
今回の事態においても、それぞれの立場で、スティグマを避けていく努力が必要です。私たちは常に、感染拡大を防ぐ、という名目のもとに、何かの属性をもった人たちを苦しめることになっていないか、留意していく必要があります。